Liczba osób potrzebujących przeszczepów przewyższa liczbę dawców organów. Rozwiązaniem mogą być świnie
(CNN) – Zeszłego lata, po ponad dekadzie choroby, Lawrence Faucette i jego żona Ann stanęli w obliczu trudnej rzeczywistości, w której zbliżał się koniec jego życia. Miał 58 lat i cierpiał na schyłkową niewydolność serca. Choroba tętnic obwodowych sprawiła, że nie kwalifikował się do przeszczepu serca.

Zdjęcie: Courtesy Ann Faucette
Po szczególnie wyczerpującym tygodniu w szpitalu, podczas którego lekarzom nie udało się przywrócić prawidłowej pracy serca, zdecydował, że ma dość. Postanowił opuścić szpital, uznając, że wolałby umrzeć w domu.
Ale zanim mógł zostać wypisany, na rozmowę z nim przyszła ostatnia pani doktor. Przez dwie godziny analizowała to, co widziała i po raz pierwszy – jak powiedziała Ann – naprawdę udzielała prostych odpowiedzi na temat jego stanu.
Podczas tej długiej rozmowy lekarz zadał nietypowe pytanie: Czy kiedykolwiek rozważyliby ksenotransplantację?
„Początkowo nie mieliśmy pojęcia, co mają na myśli, ale byliśmy zainteresowani wszystkim” – powiedziała Ann.
Ann i Larry znali się trochę na nauce. Poznali się trzydzieści lat wcześniej, uczęszczając do szkoły laboratorium medycznego, gdy oboje służyli w wojsku. Rozumieli, że ksenotransplantacja oznacza przeszczepianie tkanki jednego zwierzęcia innemu gatunkowi. Wiedzieli, że lekarze od dawna używają zastawek świńskich do naprawy ludzkiego serca.
Larry Faucette nie miał nic przeciwko byciu „ludzkim królikiem doświadczalnym”, jeśli mogłoby to pomóc innym, powiedziała jego żona, Ann. Dzięki uprzejmości Ann Faucette
Ale to, co oferowano teraz, było czymś innym: zdrowe serce można było przeszczepić Larry'emu od świni, która została genetycznie zmodyfikowana, aby jej narządy były bardziej kompatybilne z ludzkim organizmem.
Przeszukując internet podczas powrotu do domu do Frederick w stanie Maryland, Larry dowiedział się, że tego rodzaju przeszczep przeprowadzono tylko u jednej żyjącej osoby. Nie było gwarancji, że zabieg się uda, a lekarze nie wiedzieli, jak długo on potrwa.
Zapotrzebowanie na narządy do przeszczepów jest ogromne i wciąż rośnie. Niektórzy naukowcy uważają, że narządy zwierzęce mogą być dobrym sposobem na zwiększenie podaży, ale nauka utknęła w martwym punkcie, ponieważ badacze próbowali dowiedzieć się, jak zapobiec odrzuceniu narządów i uniknąć niebezpiecznych infekcji. Muszą również rozwikłać skomplikowane kwestie etyczne, w tym sposób testowania takich narządów.
Lista oczekujących na przeszczep narządów w USA jest dwukrotnie dłuższa niż liczba ukończonych w 2023 r
W 2023 r. przeprowadzono 46 630 przeszczepów narządów, ale na liście oczekujących nadal znajduje się ponad 103 000 osób.
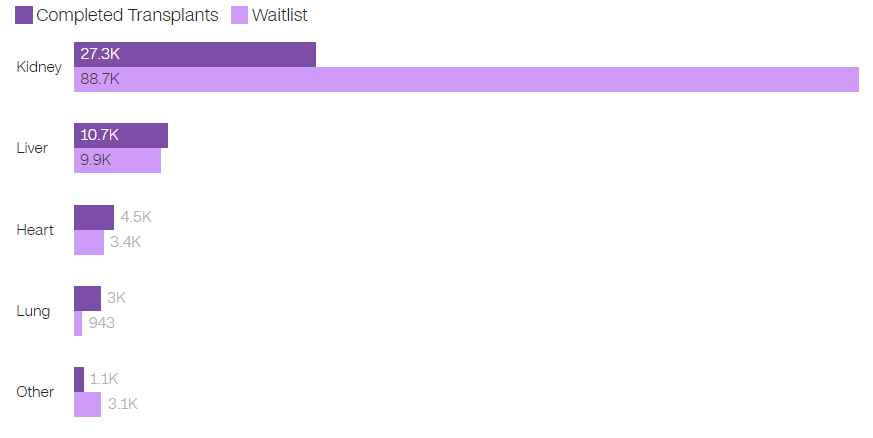
Grafika: Deidre McPhillips, CNN Źródło: Sieć Pobierania i Przeszczepiania Narządów
Uwaga: dane dotyczące listy oczekujących na dzień 29 stycznia 2024 r. Inne obejmują przeszczepy trzustki, nerki/trzustki i przeszczepy alloprzeszczepowe, takie jak twarz, dłonie i ścianki brzuszne.
Jednak ostatnie postępy w klonowaniu i edycji genów, wraz z lepszym zrozumieniem kontroli infekcji, doprowadziły kilka instytucji do przełomu - kluczowych kroków, które mogą pozwolić wkrótce Amerykańskiej Agencji Żywności i Leków na zatwierdzenie badań klinicznych.
Naukowcy przeszczepili genetycznie zmodyfikowane świńskie nerki i serca ludziom, którzy byli w stanie śmierci mózgowej, aby sprawdzić, czy działają one u ludzi. W tym miesiącu lekarze wykazali, że wątroba świni może filtrować krew, gdy jest podłączona do niedawno zmarłej osoby. W zeszłym tygodniu lekarze stwierdzili, że zidentyfikowali mieszankę leków immunosupresyjnych potrzebnych do zapobiegania odrzuceniu świńskich nerek przez ludzkie ciała.
Dwukrotnie chirurdzy przeszczepili genetycznie zmodyfikowane serca żywym ludziom: chętnym uczestnikom testów, którzy rozumieli, że ich śmierć jest nieuchronna i że żaden przeszczep prawdopodobnie ich nie uratuje, ale że ksenotransplantacja może uratować wiele istnień w przyszłości.
Chociaż Larry Faucette był zbyt chory na przeszczep ludzkiego serca, lekarze z University of Maryland stwierdzili, że fizycznie wydawał się wystarczająco silny, by przeszczepić mu genetycznie zmodyfikowane świńskie serce. Wysłali go do szeregu ekspertów: chirurgów, którzy wyjaśnili procedurę, etyka medycznego, pracowników socjalnych i psychologa.
Po tym, jak we wrześniu FDA zatwierdziła procedurę w ramach programu „compassionate use”, został on biorcą świńskiego serca zmodyfikowanego do pracy w ludzkim organizmie.
Larry, naukowiec kontraktowy w Narodowym Instytucie Alergii i Chorób Zakaźnych od prawie 10 lat, realistycznie oceniał swoje szanse na serce. Czuł jednak, że jeśli może to pomóc lekarzom w nauce i ostatecznie przynieść korzyści innym, nie będzie miał nic przeciwko byciu "ludzkim królikiem doświadczalnym" - powiedziała Ann.
Mimo to Ann miała nadzieję, że to zadziała, nawet jeśli miałoby działać tylko przez chwilę.
„Złamany paradygmat”
W Stanach Zjednoczonych ponad 100 000 osób czeka na przeszczep narządu. Nie ma wystarczającej liczby dawców, a nawet gdyby wszyscy się do tego zgłosili, mniej niż 1% ochotników umiera w taki sposób, że ich narządy nadają się do przeszczepu. Przeciętnego dnia 17 osób umiera w oczekiwaniu na narząd.
„To, że ktoś musi umrzeć, aby ktoś mógł żyć, jest złamanym paradygmatem” - powiedział dr Robert Montgomery, dyrektor NYU Langone Transplant Institute i jeden z badaczy zajmujących się ksenotransplantacją. „Myślę, że zwierzęta są odpowiedzią”.
Dla Montgomery'ego nauka ma wymiar osobisty. W 1976 roku, gdy miał 14 lat, stracił ojca z powodu niewydolności serca. Było to ponad dekadę po pierwszym przeszczepie serca, ale na długo przed tym, jak takie procedury stały się stosunkowo rutynowe.
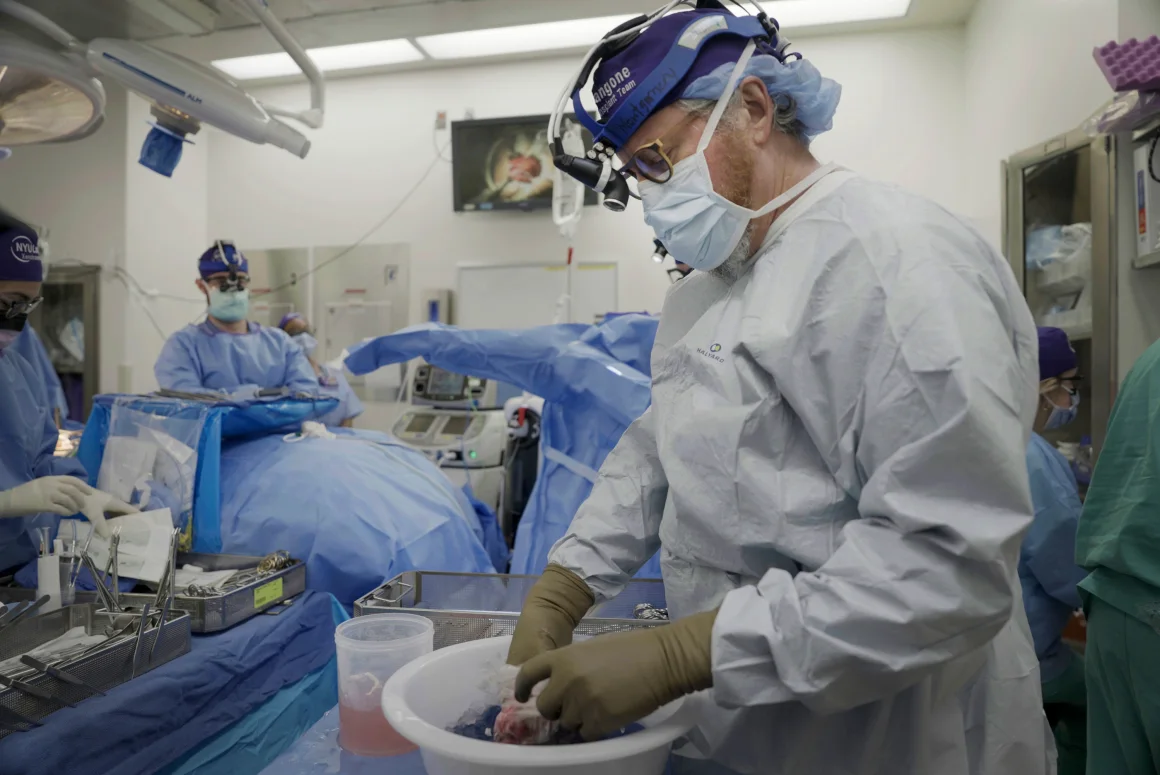
Ksenotransplantacja jest bardzo bliska dr Robertowi Montgomery'emu, dyrektorowi NYU Langone's Transplant Institute. Shelby Lum/AP
W tamtym czasie lekarze twierdzili, że przeszczep nie jest tego wart. Chociaż obecnie większość pacjentów przeżywa i może żyć wiele lat dzięki przeszczepom serca, w latach 70. mniej niż połowa osób, którym przeszczepiono serce, żyła dłużej niż rok.
„To siedziało w moim mózgu przez te wszystkie lata” - powiedział Montgomery.
Ma ten sam problem genetyczny, który spowodował niewydolność serca jego ojca. Pięć lat temu przeszedł własny przeszczep serca. Liczba dawców narządów jest jednak tak ograniczona, że siedem razy doszło u niego do zatrzymania akcji serca, zanim w ogóle zakwalifikował się na listę dawców.
„Wiesz, musisz lecieć obok słońca, nie kończąc na spaleniu się, co robi większość ludzi” - powiedział Montgomery. Powiedział, że ksenotransplantacja „naprawdę wszystko zmieni”.
Przeszczepianie narządów od zwierząt do ludzi nie jest nowym pomysłem. Kilkadziesiąt lat temu lekarze uważali naczelne ssaki za najlepszych kandydatów do ksenotransplantacji, a w 1984 roku przeszczepili serce pawiana dziecku, które żyło przez 21 dni.
„Ale naczelne ssaki okazały się zbyt małe, zbyt drogie i zbyt kontrowersyjne” - powiedział dr Art Caplan, profesor bioetyki i założyciel Wydziału Etyki Medycznej na Wydziale Zdrowia Ludności NYU Grossman School of Medicine. Nie rozmnażały się one też tak szybko jak świnie.
Podsumowując, Caplan powiedział: „To nie zadziałało”.
Narządy świń są jednak anatomicznie podobne do ludzkich. Od ponad trzech dekad świńskie zastawki serca są wykorzystywane do naprawy ludzkich serc. Świńskie produkty wchodzą w skład dziesiątek leków ratujących życie, takich jak epinefryna, która jest stosowana w leczeniu ciężkich reakcji alergicznych, oraz heparyna, lek rozrzedzający krew.
Ludzie są również bardziej etycznie zadowoleni z narządów pochodzących od świń niż od małp, powiedział Caplan. Świnie występowały w historiach „Disneya”, które sprawiają, że ludzie są współczujący, ale „Babe” i „Pajęczyna Charlotty” nie powstrzymały wszystkich przed jedzeniem wieprzowiny „w tempie około miliarda rocznie” - powiedział Caplan. „Więc trochę trudno jest sprzeciwić się wykorzystaniu tuzina świń w przeszczepach”.
Mimo to przeszczepienie całego narządu od świni było trudne ze względu na różnice genetyczne, które powodują, że ludzkie ciało je odrzuca. Istnieją również obawy, że świński organ może przenosić utajonego wirusa, który może zaszkodzić ludzkiemu biorcy, a nawet rozprzestrzenić się na innych ludzi.
Droga do nadziei
Na farmie badawczej na Środkowym Zachodzie, chrząkające, węszące świnie o mokrych nosach przesuwają się na przód swoich zagród, mając nadzieję na słodką piankę. Są one hodowane przez eGenesis, jedną z firm biotechnologicznych opracowujących zwierzęta do ksenotransplantacji, do badań obejmujących badania na naczelnych.
„Ci dawcy mają potencjał, by ratować ludzkie życie” - powiedział dyrektor generalny i prezes eGenesis, dr Mike Curtis, głównemu korespondentowi medycznemu CNN, dr Sanjayowi Gupcie, gdy przyglądał się zwierzętom znajdującym się pod jego opieką. „Jesteśmy tak blisko”.
Aby stworzyć świnie, eGenesis zaczyna od próbki skóry wyizolowanej z rasy zwanej Yucatan minipig i hoduje ją w celu rozszerzenia komórek, a następnie wykorzystuje CRISPR do wprowadzenia 69 zmian, które wstawiają niektóre ludzkie geny i usuwają niektóre geny świń. Inne firmy, w tym te, które dostarczyły narządy do najnowszych eksperymentów na ludziach, używają mniejszej liczby zmian.
Aby przekształcić zmodyfikowane komórki w świnię, wymagane jest klonowanie, pobranie zmodyfikowanych komórek i połączenie ich z komórką jajową dawcy, z której usunięto jądro, w celu stworzenia zarodka świni. Zarodek ten jest następnie przenoszony do lochy zastępczej. Zmodyfikowane genetycznie prosięta rodzą się przez cesarskie cięcie i są wychowywane przez personel eGenesis.
W trakcie całego procesu świnie są trzymane w niezwykle czystych warunkach. Kiedy ludzie wchodzą z nimi w interakcję, nawet po to, by dać im piankę, muszą brać prysznic i nosić buty i ubrania dostarczone przez firmę. We wczesnym okresie życia świnie są szczególnie podatne na infekcje - a infekcja może stanowić poważne zagrożenie dla ludzkich biorców.
„Aby uruchomić całą tę technologię, musimy mieć równowartość pięciu lub sześciu odkryć Nagrody Nobla” - powiedział Curtis. „Integrujemy je wszystkie, aby uczynić to rzeczywistością”.
Rzeczywistość jest taka, że ksenotransplantacja ma jeszcze wiele do zrobienia, zanim będzie dostępna dla ogółu społeczeństwa.
Nie była ona jeszcze badana w testach klinicznych. FDA powiedziała CNN, że ksenotransplantacja wykazuje „wielką obietnicę, ale istnieje również potencjalne ryzyko” i że zaleca, aby takie przeszczepy były ograniczone do osób z poważnymi lub zagrażającymi życiu chorobami, dla których nie są dostępne odpowiednie alternatywy.
Dla tych pacjentów i ich rodzin jest to wąska ścieżka do nadziei.
Pierwsze próby
We wrześniu 2021 roku Julie O'Hara pomagała swoim dzieciom zaplanować pogrzeb ich ojca, kiedy otrzymała pilny telefon od chirurga. W tamtym czasie nie miało to sensu: Jim Parsons, lat 57, był w stanie śmierci mózgowej po wypadku na rowerze terenowym i nie było szans na przeżycie.
Dr Jayme Locke, dyrektor Kompleksowego Instytutu Transplantacji Uniwersytetu Alabama w Birmingham, zasadniczo powiedziała, że nie może przywrócić byłego męża O'Hary, ale może uczynić go ważną częścią historii medycyny. Locke prosiła o przeszczepienie dwóch genetycznie zmodyfikowanych świńskich nerek Parsonsowi, nie dlatego, że ich potrzebował lub dlatego, że mogłyby go uratować, ale dlatego, że dałoby to lekarzom szansę sprawdzenia, czy świńskie narządy mogą bezpiecznie funkcjonować w ludzkim ciele.

Dla rodziny Jima Parsonsa świadomość, że pomógł on w rozwoju nauki, stanowi pewne pocieszenie. Zdjęcie: Rodzina Parsonsów/Uniwersytet Alabama w Birmingham
Wcześniej w tym samym miesiącu zespół z NYU - w tym Caplan i Montgomery - zaplanował i przeprowadził podobną procedurę, przeszczepiając genetycznie zmodyfikowaną świńską nerkę osobie z martwym mózgiem. Przez 54 godziny nerka produkowała mocz i wydawała się działać tak, jak przeszczep ludzkiej nerki, i nie było żadnych oznak odrzucenia.
O'Hara powiedział, że Parsons chciałby być częścią tych badań. „Wiemy, że dawstwo narządów było dla nas zdecydowanie najlepszym rozwiązaniem” - powiedziała.
Za zgodą O'Hary podjęto szybkie działania w celu przeszczepienia dwóch świńskich nerek.
„W pewnym sensie było to surrealistyczne” - powiedziała Locke. „Można niemal poczuć, jak pomieszczenie wstrzymuje oddech, a następnie wydycha powietrze, gdy zaciski znikają, a nerka zmienia kolor na różowy i zaczyna wytwarzać mocz”.
„Skala tego, co robimy, tego, jak staramy się pomagać ludziom, jest ekscytująca, przytłaczająca, pokorna i radosna”.
Następnego roku, w styczniu 2022 r., chirurdzy z University of Maryland School of Medicine dokonali kolejnego skoku i przeszczepili genetycznie zmodyfikowane świńskie serce żywej osobie.
David Bennett Sr., lat 57, był w końcowym stadium niewydolności serca i od tygodni był przykuty do łóżka, podłączony do maszyny, aby jego serce i płuca mogły pracować. Nie kwalifikował się do przeszczepu ludzkiego serca.
Opcja przeszczepu serca świni była jak jedno z tych "gradowych podań Maryi" w meczach piłki nożnej, które uwielbiał jego ojciec, powiedział syn Bennetta, David Jr.
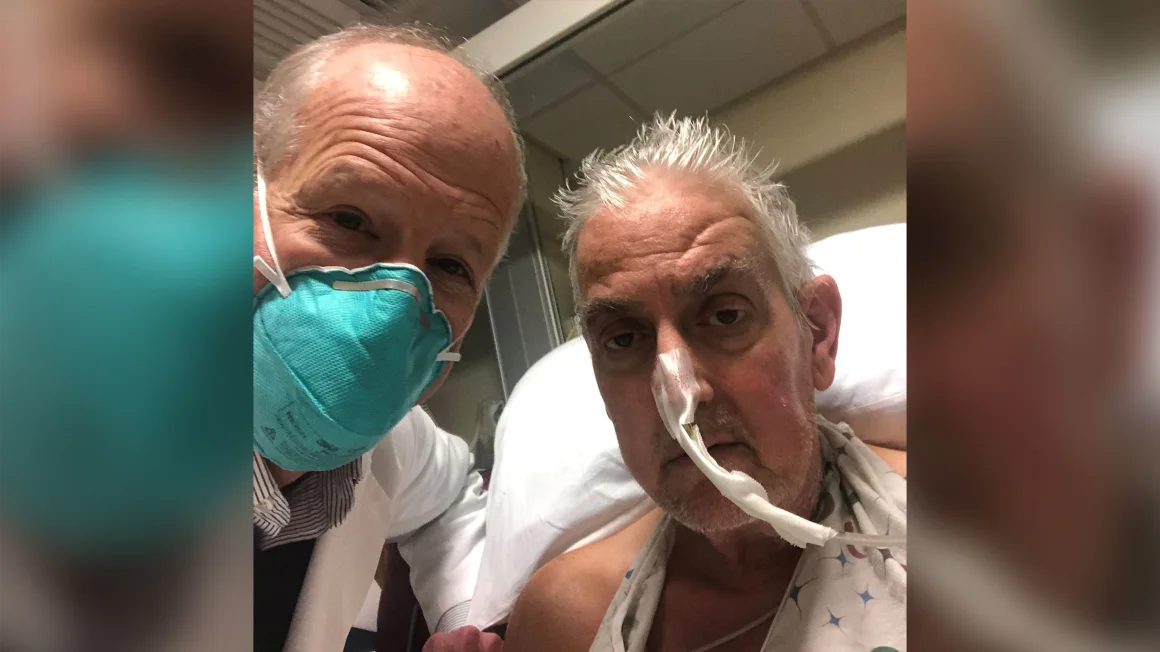
Dr Bartley Griffith i David Bennett Sr. w styczniu 2022 r. Zdjęcie: University of Maryland School of Medicine
Przez kilka tygodni wszystko działało dobrze. Stał się silniejszy i początkowo jego ciało nie wykazywało żadnych oznak odrzucenia serca. Był w stanie odwiedzać rodzinę, poddawać się fizykoterapii, a nawet był na tyle silny, że mógł oglądać Super Bowl. Wideo pokazuje, jak słabo śpiewa „America the Beautiful” ze swoim fizjoterapeutą.
Bennett miał nadzieję wrócić do domu i zobaczyć swojego ukochanego psa, Lucky'ego, ale około 40 dni po operacji, jak powiedział jego syn, serce dawcy zaczęło zawodzić. Później lekarze ustalili, że istniało kilka nakładających się na siebie problemów. Jednym z nich był wirus pochodzący od świni, który nie rozprzestrzenił się w innych częściach ciała, ale doprowadził do uszkodzenia serca.
Świnia dawca była wielokrotnie badana pod kątem patogenów przy użyciu protokołów zaakceptowanych przez FDA, a serce zostało zmodyfikowane genetycznie, aby wyeliminować ryzyko infekcji i odrzucenia. Bennett otrzymał również leki zapobiegające odrzuceniu, a personel szpitala zastosował specjalne procedury izolacji pacjenta i sprzętu; od tego czasu wprowadzono ulepszone protokoły testowe.
Mimo to, 8 marca, około dwa miesiące po zabiegu, Bennett zmarł.
„To było bardzo trudne, ale przynajmniej mogliśmy spędzić dodatkowy czas, a bycie częścią tego historycznego momentu było czymś niezwykłym” - powiedział jego syn.
Lekarze twierdzą, że przeszczepy u żywych biorców nauczyły ich o wiele więcej niż to, czego mogliby się nauczyć z modelu zwierzęcego.
„Każdy przeszczep, który wykonaliśmy, od pierwszego, wiele nas nauczył” - powiedział dr Muhammad M. Mohiuddin, profesor chirurgii i dyrektor naukowy/programowy programu ksenotransplantacji serca na University of Maryland School of Medicine.
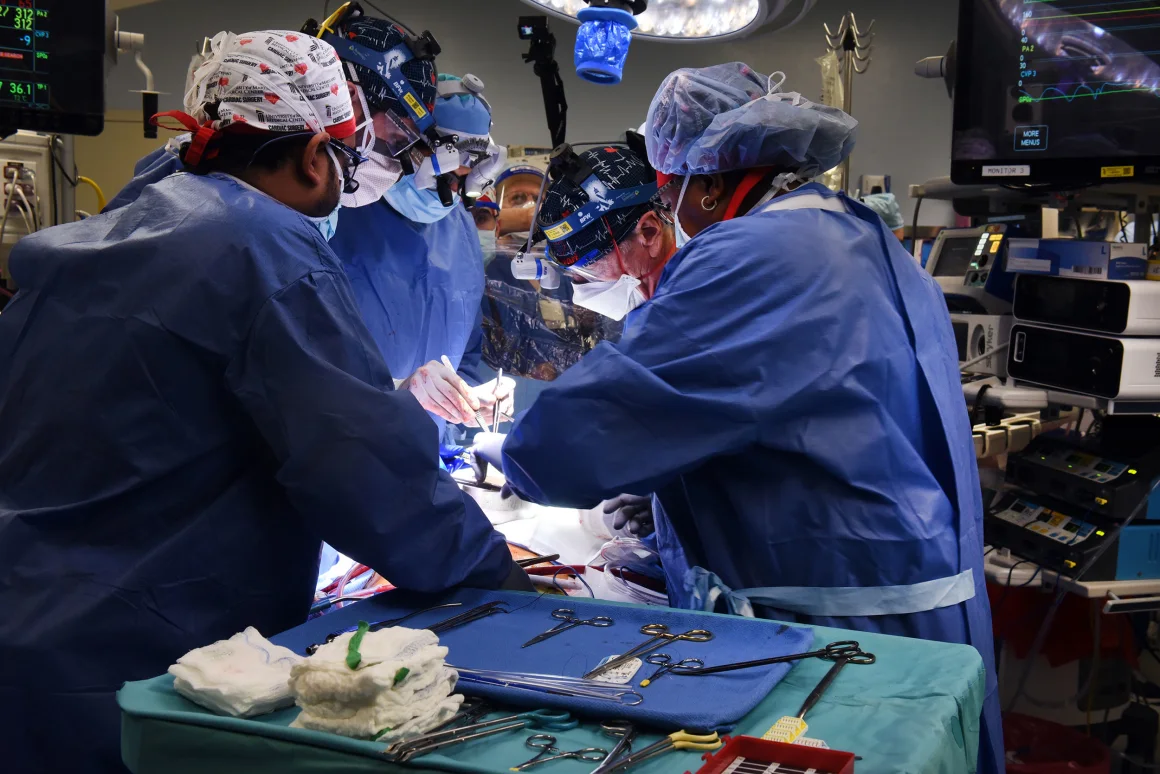
Lekarze przeszczepiają pacjentowi genetycznie zmodyfikowane serce świni. Zdjęcie: University of Maryland School of Medicine
Chociaż lekarze rozumieli, jak te przeszczepy działają u zwierząt, nie rozumieli nawet niektórych podstaw, które musieliby znać, aby zbliżyć naukę do badań klinicznych.
„Dowiedzieliśmy się, że serce świni jest odpowiednim substytutem ludzkiego serca. Nie mogliśmy tego powiedzieć, dopóki nie włożyliśmy świńskiego serca i, podobnie jak w przypadku kosiarki spalinowej, nie uruchomiliśmy go, a następnie pozwoliliśmy mu pracować” - powiedział dr Bartley Griffith, członek zespołu transplantacyjnego Larry'ego Faucette'a i Davida Bennetta oraz profesor kardiochirurgii w University of Maryland Medical Center.
„W rzeczywistości pierwsze serce nazwałem „gwiazdą rocka”, ponieważ po prostu pięknie kręciło się i ściskało” - dodał Griffith. „Przed odrzuceniem przewyższało typowy ludzki przeszczep”.
Przyszłość ksenotransplantacji
Ann Faucette powiedziała, że ona i jej mąż nie żałują, że zdecydowali się na przeszczep świńskiego serca, ale trudno było patrzeć, jak miłość jej życia przechodzi wzloty i upadki po zabiegu.
Częściowo pomógł im w tym humor. Gdy tylko Larry mógł mówić po operacji, jedną z pierwszych rzeczy, o które poprosił, była koszulka z napisem „Just call me Wilbur”, imieniem świni w centrum ukochanej powieści E.B. White'a „Pajęczyna Charlotty”. Kiedy lekarze musieli usunąć płyn z okolic jego serca, poprosił o narysowanie świni na bandażu.
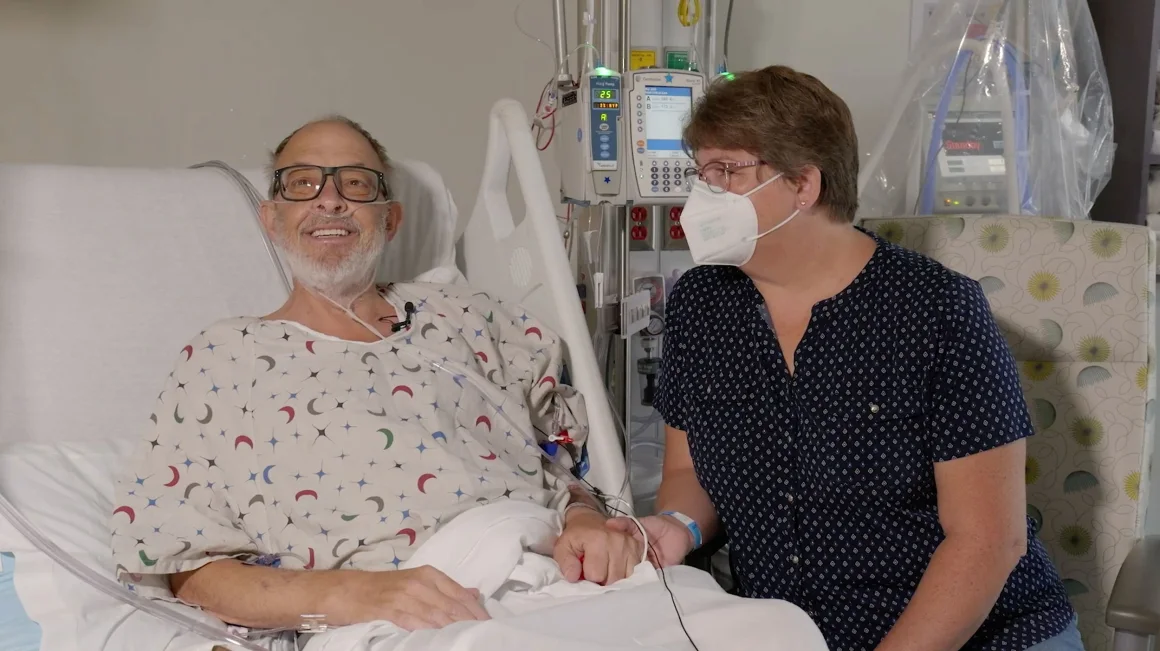
Ann Faucette mówi, że humor pomógł jej i mężowi Larry'emu przetrwać wzloty i upadki, które nastąpiły po jego przeszczepie. Zdjęcie: University of Maryland School of Medicine
W dobre dni Larry odwiedzał rodzinę. Prawie codziennie grali w Uno, a w końcu był w stanie wstać z łóżka i pedałować na leżącym rowerze. Złe dni były głównie wtedy, gdy potrzebował więcej operacji. Jego serce nie biło wystarczająco szybko, więc lekarze dodali rozrusznik serca. Jeden z przewodów urządzenia zrobił małą dziurę, więc trzeba było go naprawić.
„Wszelkie postępy, które początkowo poczynił, tak naprawdę stracił, wracając wielokrotnie na salę operacyjną” - powiedziała Ann.
Pod koniec października serce wydawało się nie pracować już tak dobrze. Lekarze codziennie informowali Larry'ego o stanie jego zdrowia, ale mógł on stwierdzić, że ilość krwi pompowanej przez serce spada. „Mógł to poczuć” - powiedziała Ann.
Larry został umieszczony na maszynie do pomostowania serca i płuc zwanej ECMO, aby dać sercu szansę na odpoczynek. Ale w końcu, jak powiedziała Ann, powiedział swojej rodzinie i lekarzom, że myśli, że to koniec. Na jego prośbę lekarze odłączyli maszynę ECMO.
Ostatniego dnia spędził czas na żartach i wspomnieniach.
„Mógł powiedzieć te rzeczy, których nie mówi się ludziom, ponieważ zawsze myślisz, że masz więcej czasu” - powiedziała Ann.
Zmarł 30 października, około sześć tygodni po operacji.
„Wiedziałam, że to nadejdzie, a potem dostałam dodatkowy czas i miałam satysfakcję, że zaakceptował to i pogodził się z tym” - powiedziała Ann. „Cóż, na tyle, na ile można być pogodzonym końcem życia”.
Ostatecznie, etyk z NYU Caplan i niektórzy inni naukowcy postrzegają ksenotransplantację jako pomost: stosunkowo krótkoterminowe rozwiązanie, które pomoże zlikwidować niedobór narządów w ciągu najbliższych pięciu do siedmiu lat, dopóki naukowcy nie wymyślą, jak zregenerować uszkodzony lub niedziałający narząd danej osoby.
Niektórzy badacze czynią postępy na przykład w dziedzinie trójwymiarowego biodruku narządów. Przeszczepy od świń mogą okazać się skuteczne, powiedział Caplan, ale „nie są tak eleganckie”.
Nie wszyscy postrzegają organy zwierzęce jako tymczasowe rozwiązanie. Mohiuddin, chirurg z Maryland, mówi, że chociaż wciąż jest wiele do nauczenia się, ksenotransplantacja będzie „ważną opcją”.
„W przyszłości może być regularnie oferowana pacjentom i miejmy nadzieję, że uratuje tysiące lub miliony istnień ludzkich” - powiedział.
Montgomery z NYU powiedział, że narządy zwierzęce mogą pewnego dnia zastąpić dializy i potrzebę stosowania urządzeń wspomagających pracę serca. Spodziewa
się, że w ciągu dekady będą one „tak powszechne, jak otrzymywanie narządów od ludzi, a może nawet bardziej powszechne”.
Dla Locke z UAB, możliwość przeniesienia ksenotransplantacji z laboratorium do łóżka to kwestia równości w zdrowiu.
„To jest to, co motywuje mnie bardziej niż cokolwiek innego, to możliwość zaoferowania tej ratującej życie terapii każdemu, kto się do mnie zgłosi” – powiedziała Locke.
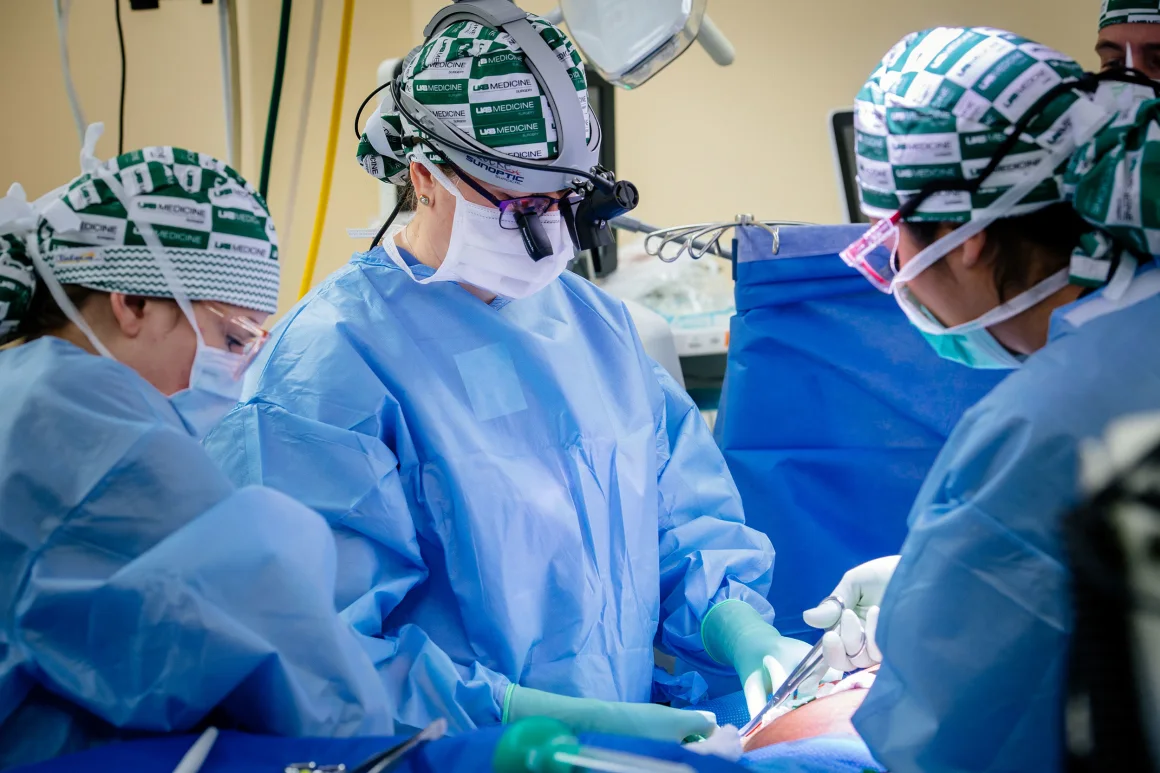
Dr Jayme Locke, w środku, mówi, że badania nad ksenotransplantacją były „ekscytujące, przytłaczające i pokorne”. Zdjęcie: Steve Wood/UAB
Ponieważ brakuje narządów, lekarze często muszą dokonywać trudnych wyborów, kto może znaleźć się na liście oczekujących. Mając realną alternatywę, nie byłoby to takim problemem.
„Czasami czuję się tak, jakbyśmy przestawiali leżaki na Titanicu, ponieważ nie mamy ich wystarczająco dużo, więc rozwiązanie tego problemu jest dla mnie bardzo ważne” - powiedziała.
Zwolennicy, tacy jak Curtis z eGenesis, twierdzą, że wykorzystanie świń jako dawców nie tylko zwiększyłoby podaż narządów, ale mogłoby obniżyć koszty przeszczepów.
Obecnie serca i płuca muszą zostać przeszczepione w ciągu sześciu godzin od pobrania. Nerki mają nieco więcej swobody, z 36-godzinnym oknem przeszczepu. Jednak w przypadku ludzkich narządów lekarze nigdy nie wiedzą dokładnie, kiedy narząd będzie dostępny, a wiedza o tym, jakie organy są w przygotowaniu, zmieniłaby sposób działania systemu i uczyniłaby go znacznie bardziej wydajnym.
„Jeśli wiemy, że mamy nieograniczoną liczbę dawców, możemy zaplanować operację” - powiedział Curtis. „To eliminuje z systemu wiele kosztów związanych z nagłymi przypadkami”.
Rodziny, których życie zostało dotknięte przez ksenotransplantację mówią, że bycie częścią rozwiązania łagodzi część bólu.
Dla dzieci Parsonsa strata ojca była tak trudna, jak każdy mógłby sobie wyobrazić, powiedziała O'Hara. Pomogło jednak to, że przekazali jego ciało nauce i byli częścią recenzowanego badania, z którego mogą uczyć się naukowcy na całym świecie. UAB nazwał również metodę testowania narządów na osobie z martwym mózgiem modelem Parsonsa, hołdem, który poruszył rodzinę.
„Nie powiem, że w jakikolwiek sposób zrekompensowało to jego śmierć, ale znacznie ułatwiło to poznanie spuścizny, którą pozostawił” - powiedziała O'Hara.
W 2023 roku, kiedy rodzina Bennetta dowiedziała się, że drugi żyjący pacjent - Larry Faucette - otrzymał świńskie serce, wysłali listy i rysunki od jego wnuków, aby okazać swoje wsparcie.
„To świat, o którym nie wiesz, że istnieje, dopóki sam się w nim nie znajdziesz, więc starasz się wspierać jako rodzina i dostrzegać wszystko, przez co rodzina przechodzi w tej podróży” - powiedział syn Bennetta.
Strata Bennetta i Faucette'a dotknęła również lekarzy, którzy z nimi pracowali. Griffith, chirurg z Maryland, powiedział, że bardzo smutno jest stracić każdego pacjenta, ale w przypadku Faucette był „naprawdę zdezorientowany przez jakiś czas”.
„Ci pacjenci byli tak wspaniali, jeśli chodzi o ich zdolność do oddzielenia własnej śmierci od tego, co ich zaangażowanie w to może oznaczać dla innych” - powiedział Griffith. „Myślę, że poczuliśmy się uwolnieni od ciężaru uczucia, że być może niewłaściwie eksperymentowaliśmy”.
W przypadku Ann Faucette śmierć męża dopada ją w nieoczekiwanych momentach: Płakała po obejrzeniu meczu NFL, który sprawił, że krzyczał. W ciągu tygodnia poddaje się żądaniom psów Larry'ego i siada między Kate i Lucy, aby obejrzeć „Let's Make a Deal”, tak jak on by to zrobił.
„Wiedział, że kiedy odejdzie, zostanie skremowany i usiądzie na moim kominku” - powiedziała Ann. Teraz urna zawierająca jego prochy znajduje się obok dwóch zdjęć świni, która przedłużyła życie jej męża, dając im prawie dwa cenne miesiące razem.
„Dla mnie to było samolubne. To było trochę więcej czas” - powiedziała Ann. „Ale dla niego była to myśl, że może zrobić coś, co naprawdę pomoże innym”.
Chce nadal rozmawiać o ksenotransplantacji, skoro on nie może. Chce widzieć więcej badań. Chce, by poświęcenie Larry'ego i jej własne coś znaczyło.
„To była kolejka górska” - powiedziała. „Ale gdybyśmy mieli zrobić to wszystko jeszcze raz, nadal byłoby tak samo. Nadal byśmy to zrobili”.
Nadia Kounang z CNN przyczyniła się do powstania tego raportu.
Dział: Aktualności
Autor:
Jen Christensen, CNN | Tłumaczenie: Aleksandra Adamus
Źródło:
https://edition.cnn.com/2024/01/30/health/pig-organ-transplant-xenotransplantation/index.html